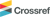페레이트를 이용한 옥시테트라사이클린의 처리 공정 개발
Abstract
Oxytetracycline is one of the most common antibiotic used in the aquaculture and livestock industry. However, excessive use of oxytetracycline occurs in the appearance of the antibiotic-resistant bacteria. In this study, we compared with the degradation efficiencies of oxytetracycline in various experimantal conditions using ferrate (VI), and identified the degradation pathways through intermediate products. Firstly, the highest degradation efficiency of oxytetracycline occurred in alkalic condition (pH 10.0 ± 0.1), because of the chemical property of ferrate (VI) according to pH. In addition, the degradation rate of oxytetracycline increased directly proportional to ferrate (VI) dose. The self-decay rate of ferrate(VI) also increaseda s well whereas the degradation efficiency for target compound of ferrate (VI) decreased. The degradation intermediates of oxytetracycline were identified with LC/MS/MS, oxytetracycline was degraded through hydroxylation and decarbonation mechnism, which finally became CO2, H2O, whereas other inorganic turned into by-products.
Keywords:
Antibiotics, Degradation efficiency, Degradation pathway, Oxytetracycline, Ferrate (VI)1. 서 론
테트라사이클린계(group) 항생물질은 페니실린계, sulfonamide계 등과 함께 수산 및 축산업계 항생물질로서 현재까지 널리 사용되는 물질이다. 2019년 기준 테트라사이클린계(group) 항생물질의 판매량은 165,922 kg으로서, 이는 페니실린계에 이어 두 번째로 높은 수치이며, 전체 판매량 중에서도 18% 정도를 차지한다.1)
이러한 물질의 과도한 사용은 국제적인 이슈로서 항생제 및 내성균 연구 필요성을 증대시켰다. 우리나라에서는 90년대까지는 성장촉진의 목적으로 배합사료 내에 첨가하기도 하였으나, 2004년부터 사료 내 항생물질 사용량을 제한하기 시작하였고, 2011년부터는 의료용 이외에는 항생물질의 사용을 전면 금지하는 정책을 추진하여 그 사용량이 크게 감소하였다. 그러나 2012년 자가치료 및 예방용으로서의 항생제 판매량이 총 판매량의 88% 정도로 증가하여 여전히 항생제의 과도한 사용이 지속되고 있다.
테트라사이클린계 항생물질은 가축의 체내에서 거의 분해되지 않고 배설물에 포함되어 환경으로 배출된다. 배출된 항생물질은 강우로 인한 지표수 및 토양 침투로 인해 지표수 및 지하수로 이동하며 이렇게 환경으로 유출된 항생물질은 항생제에 노출된 내성균이 발생하는 원인이 된다.2)
항생제 사용 및 내성 모니터링1) 연구 결과, 소의 분변에서 분리한 대장균의 항생물질 내성률은 39.5%인 것으로 조사되었고, 오리, 닭, 돼지에서 유래된 균주의 항생물질 내성률은 각각 48.6%, 68.5%, 68.3%인 것으로 조사되었다. 이 외에도 축사 등 가축 관련 시설에서 내성균이 발견되었으며3) 어류 양식장에서 항생물질 내성균을 검출된 사례 역시 보고되었다.4) 다만, 최근까지 항생물질의 독성에 대해서 정량적인 기준치는 전해지지 않았으나, 환경으로 유출될 경우 동식물에 어느 정도 영향을 미치는 것으로 추정된다. Wollenberger5)는 물벼룩(D. magna)을 이용하여 각각 생물농축성과 독성을 시험한 바 있다. 특히 테트라사이클린계 항생물질은 비교적 토양이나 유기물에 흡착되는 특징이 강하며6) 양배추나 오이, 당근, 토마토와 같은 농작물에 흡수되어 독성을 일으키거나 식물체 내에 축적되어 인간에게까지 미칠 수 있을 것으로 추정된다.7)
고급산화(AOPs, advanced oxidation processes) 기술은 산화력이 강한 OH 라디칼을 발생시켜 대상물질을 분해제거하는 프로세스로서, 2000년대부터 항생물질을 대상으로 한 시도가 시작되었고, UV8), H2O29), 오존10), 광촉매11), 초음파12) 등 여러 가지 기술을 적용하여 연구를 진행한 바 있다. 그러나 고급산화기술의 경우, 높은 농도의 항생물질 처리에는 적합하지 않으며, 프로세스에 따라 브롬계 물질이나 염소산화물 등 유해한 반응부산물이 발생하는 경우도 있다.
이 중 Ferrate(VI)는 6가철로, 강한 산화력을 가지고 있어 병원균 제거 및 수질정화에 효과적으로 알려져 있다. 또한 산화 후 생성되는 3가철은 자연계에 무해하고, 수처리공정의 응집제로도 작용할 수 있어 “친환경 소재, green chemical”로 불리기도 한다. 최근에는 sulfonamides, fluoroquinolones, ibuprofen, dichlofenac, 등의 의약물질13-15), PPCPs(개인 위생물질)과 EDCs(내분비계 장애물질)을 처리하기 위한 시도도 활발히 진행 중에 있다.
본 연구에서는 실험실에서 제작한 칼륨페레이트(potassium ferrate(VI))를 이용하여 여러 가지 수질 환경에서 중요한 테트라사이클린계 항생물질 중 하나인 옥시테트라사이클린(oxytetracycline)의 분해 기작을 연구하여 가장 효율적인 pH 적용 조건과 최적의 처리 효율을 보이는 페레이트 투입량을 선정함을 목적으로 한다. 또 oxytetracycline 분해 시 생성되는 중간생성물들을 조사함으로써 페레이트에 의한 분해 메커니즘을 제시하였다.
2. 연구 방법
2.1 시약 및 재료
본 실험에서 사용된 모든 시약은 1급 이상의 시약만을 사용하였다. 옥시테트라사이클린 (99%)은 시그마-알드리치(USA)사의 oxytetracycline hydrochloride (≥95%) 제품을 구입하였으며, 500 μM로 제조하여 냉장 암실상태에서 보관 후 2일 내로 사용하였다. 페레이트의 원료인 철염은 Daejung(Korea) 사의 Fe(NO3)3·9H2O(99%)를 사용하였고, 페레이트 합성에 필요한 알카리 용액의 제조에 필요한 KOH(97%)와 NaOCl(유효염소>8%)는 준세이 (Japan) 사에서 구입하였다. 또한 페레이트 제조 후 세척 시 사용되는 유기용매로는 n-헥산 (Budrick & Jackon, HPLC), n-펜탄(Samchun, 99%), 메탄올(Budrick & Jackon, HPLC), diethyl ether(준세이, 99.5%)를 사용하였으며, 제조과정 중 여과과정에 사용된 GF/C filter는 Whatman(UK) 사의 제품을 사용하였다. 페레이트를 주입할 옥시테트라사이클린 반응 시료는 pH 조절을 위해 무기인 버퍼용액을 사용하였으며, 버퍼용액 제조 시 사용된 시약은 NaH2PO4·2H2O(99%, 칸토 Chemical Co., Japan), Na2HPO4·12H2O(>99%, 준세이, Japan), Na3PO4·12 H2O(>99%, 준세이, Japan), CH3COOH (99.5%, 신요 Chemicals Co., Japan)이다. 실험에 사용되는 반응 시료는 원시료(stock solution)에 무기인 버퍼용액을 약 15 mM을 첨가하였으며, 옥시테트라사이클린의 농도는 100 μM으로 하여 실험 시 제조하였다. HPLC의 eluent로는 NEW HUMAN UP 900(Korea, Human Co.) 초순수 제조기에서 생산되는 초순수와 Burdick & Jackson(USA) 사의 HPLC급 아세토니크릴과 준세이(Japan)사의 H3PO4 (>85%)를 사용하였다. 페레이트 측정에 필요한 ABTS diammonium salt (>98%)는 시그마-알드리치사의 제품을 사용하였다.
2.2 페레이트 제조방법
본 연구에서 사용된 칼륨페레이트의 제조는 Li et al.(2005)을 참조하였다(Fig. 1). 냉장 보관된 NaOCl 100 mL에 KOH 30 g을 투여한 뒤 교반하여 완전히 용해시키고, GF/C filter로 여과하여 수중에 잔류하는 NaCl을 제거한 후 냉장고에 보관하여 저온상태를 유지하였다. 이 상태에서 11.1 g의 Fe(NO3)3·9H2O를 투여한 후 약 40분 정도 교반하여 페레이트를 합성하고, 이를 고체화하기 위해 16.7 g의 KOH를 투여하여 약 40분 정도 교반하고 30분 정도 저온상태로 보관하였다. 보관 후 용액은 G4 유리 필터로 filtering한 후 용액은 포화 KOH 용액에 바로 투여하여 다시 저온 보관하였다. 이후 GF/C filter로 여과하면 검은 물질의 페레이트 결정을 얻을 수 있다. 더 높은 순도의 결정을 얻기 위해서 3 M KOH를 이용하여 페레이트 결정을 녹인 후 다시 포화 KOH 용액과 혼합하여 저온 보관 후 GF/C filter로 여과하는 과정을 2회 반복하였다. 최종적으로 여과지에 남은 물질은 n-헥산, n-펜탄, 메탄올, diethyl ether로 순차적으로 세척한 후 진공 상태에서 건조하여 보관하였다. 제조한 페레이트는 ABTS 측정법16)을 이용하여 DR 5000 UV-spectrometer(HACH)로 측정하였으며, 90% 이상의 순도를 가지는 페레이트를 실험에 사용하였다.
2.3 실험 및 분석방법
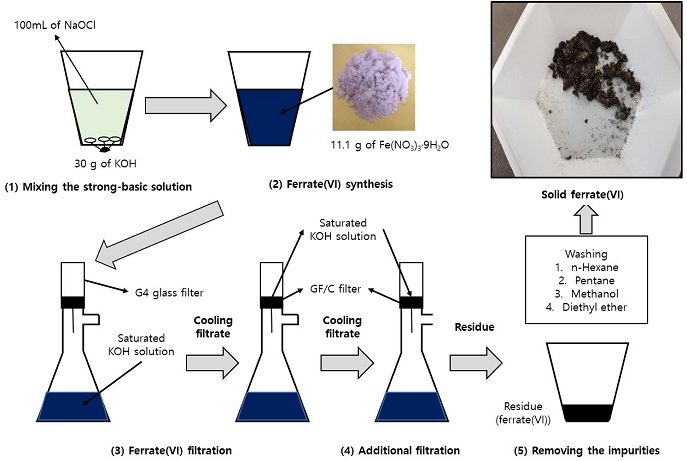
페레이트를 이용한 옥시테트라사이클린 분해실험은 batch mode로 진행하였다(Fig. 2). 실험에 사용된 반응기(reactor)는 약 740 mL의 이중자켓(double-jacket) 구조로 되어 있으며, 냉각 장치로부터 외부관을 통해 냉각수를 주입하여 일정한 온도를 유지하였다. 반응기 하단에는 막대 자석(magnetic stirrer)를 투입하여 실험 시 페레이트가 용기 내부로 투입된 후 즉시 시료와 혼합되도록 하였으며, 상단에는 pH 측정기와 수온계를 설치하여 실시간으로 pH와 수온을 측정할 수 있도록 하였다. 반응기 상단에는 테프론으로 밀봉함으로써 외부와의 접촉을 차단하였다.
페레이트 주입 후 10분까지 일정 시간 간격으로 반응기 내부의 시료 5 mL를 채취하였으며, 채취한 시료에 바로 5 mM Na2S2O3 1 mL를 주입함으로써 시료 내에서의 페레이트 반응을 억제하였다. 그리고 0.2 μm 나이론 주사기로 필터링하여 분해효율 평가와 중간생성물 연구를 위한 분석시료로 사용하였다.
분해효율 평가를 위한 시료분석은 Shimadzu사(Japan) HPLC/DAD를 이용하여 분석하였다. HPLC에 장착된 칼럼은 Waters사(USA) C18 SunFire Column (4.6 × 150 mm, 5.0 μm)이며, 온도는 40℃를 유지하였다. eluent로는 acetonitrile (solvent A)과 0.05% H3PO4가 포함된 초순수(solvent B)를 시용하였으며, eluent 유속은 0.1 mL/min으로 설정하였다. 분석시료 중 20 μL를 HPLC에 주입하여 분석하였으며, 옥시테트라사이클린을 검출하기 위한 DAD의 흡광도는 350nm로 설정하였다.
중간생성물 분석은 UPLC/maXis HD Q-TOF(Bruker, German)과 Waters사(USA) ACQUITY BEH C18 Column(2.1 × 100 mm, 1.7 μm)을 사용하여 ESI positive 모드 하에 50 ~ 1600 m/z의 범위에서 5μL의 시료를 투입하여 정성분석으로 수행하였다. eluent는 0.1% formic acid가 포함된 초순수(solvent A)와 0.1% formic acid가 포함된 아세토니크릴(solvent B)를 사용하였으며, 유속은 0.2 mL/min이고, eluent의 비율(A/B)은 처음(0 min)에는 90/10의 비율에서 시작하여 10분까지 10/90으로 조절한 후 17분까지 유지하였다가 18분까지 다시 90/10으로 조절하여 20분까지 유지하였다.
3. 결 과
3.1 페레이트에 의한 분해효율
pH에 따른 페레이트의 옥시테트라사이클린 제거효율을 비교하기 위하여 산성(pH 3.95 ± 0.1), 중성(pH 7.05 ± 0.1), 염기성(pH 10.10 ± 0.1) 환경에서 100 μM의 옥시테트라사이클린 수용액의 수온을 20 ± 0.2℃로 맞추고, 페레이트를 100 μM를 투여하여 시간별 옥시테트라사이클린 분해율을 비교한 결과는 Fig. 3을 통해 나타내었다.
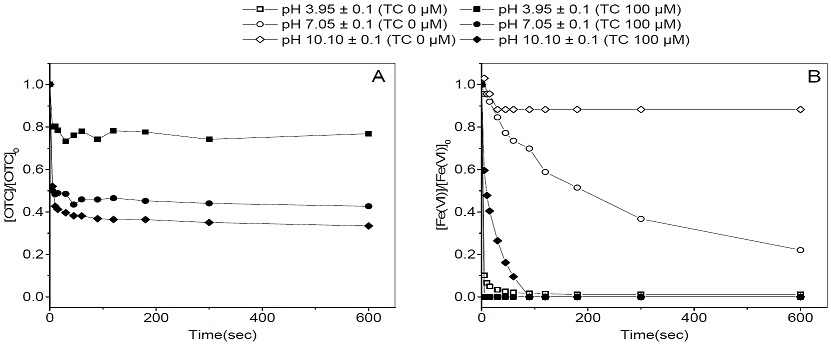
Effect of pH on oxytetracycline removal (A) and ferrate(VI) decomposition (B) (Ferrate(VI) dosage : 100 μM, Water temp. : 20℃)
산성 환경에서의 옥시테트라사이클린 분해율은 10초 후 20%, 10분 후 23% 정도로 단시간에 반응이 완료되었으며, 이후 농도 변화는 거의 나타나지 않았다. 중성 환경에서의 분해율은 10초 후 52%, 10분 후 57%로 10초 내에 대부분의 분해반응이 이루어지나, 산성 환경에 비해 높은 분해효율을 보였다. 염기성 환경에서의 분해율은 10초 후 57%, 10분 후 67%로 대부분의 반응이 10초 내에 진행되나 이후에도 옥시테트라사이클린이 지속적으로 감소하는 것으로 나타났다.
이러한 현상은 옥시테트라사이클린이 분해될 때의 페레이트 농도 변화를 보면 알 수 있다. 먼저 옥시테트라사이클린이 존재하지 않을 경우를 보면, 산성 환경에서는 페레이트가 투여 즉시 100% 환원되었으며, 중성 환경에서는 페레이트가 존재하나 지속적으로 감소하여 10분 후에는 전체 중 78%가 환원되었다. 염기성 환경에서는 페레이트가 비교적 안정적인 상태로 존재하여 10분 후에는 전체 중 12%만이 환원되어 염기성 상태에서 페레이트가 더 오래 잔류함을 알 수 있다. 또한 옥시테트라사이클린이 존재할 경우, 페레이트의 농도를 보면 산성과 중성 환경에서는 페레이트 투여 즉시 환원되었으며, 염기성 환경에서는 투여 후 1분 정도까지는 페레이트가 검출되었다. 페레이트 농도 분석 결과, 옥시테트라사이클린이 존재할 때와 그렇지 않을 경우의 페레이트의 잔류량의 차이가 크며, 산성 환경에서는 페레이트가 투여 즉시 자가분해되어 옥시테트라사이클린과의 반응에 참여하는 양이 적은 반면, 중성 환경에서는 자가분해되는 양이 비교적 적으나 잔류하는 페레이트 대부분이 옥시테트라사이클린과의 반응에 참여하는 것으로 볼 수 있다. 염기성 환경에서는 페레이트가 안정적으로 존재하여 옥시테트라사이클린 분해에 참여하기 때문에 옥시테트라사이클린이 존재하는 환경에서도 페레이트가 비교적 오래 잔류하며, 산성과 중성 환경에 비해 높은 분해효율을 보이는 것으로 판단된다.
반면, pH에 따른 옥시테트라사이클린 자체의 화학종 변화에 따라서도 분해율이 달라질 수 있다. 실제로 옥시테트라사이클린이 아닌 다른 물질을 대상으로 한 연구에서는 염기성 환경이 아닌 중성이나 산성에서 더욱 높은 분해효율을 보이기도 하는데, 이와 관련하여 Graham17)은 대상물질의 pKa에 따라 이온화 정도가 달라져 페레이트에 의한 분해 효율 또한 달라질 수 있다고 하였고, Li18)는 대상물질의 pKa와 최적 분해 효율을 보이는 pH가 비슷한 것을 확인하였으며, 대상물질이 탈양성자화된 형태(de-protonated form)로 존재하면서 페레이트가 최대한 안정화될 수 있는 pH에서 최적 분해효율을 보인다고 보고하였다.
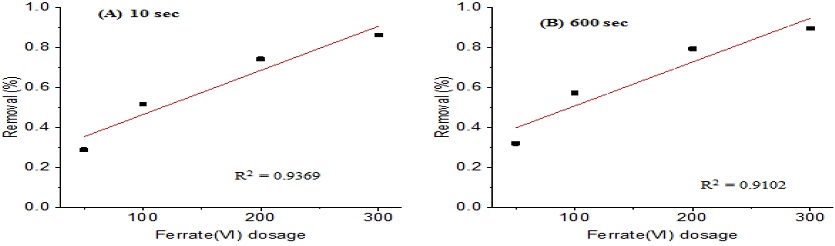
옥시테트라사이클린 분해에 필요한 최적의 페레이트 농도를 결정하기 위하여 pH 7, 20℃의 수중 환경에서 옥시테트라사이클린의 농도는 100μ로 고정하여 페레이트 농도를 50 ~ 300μM로 조정하여 실험을 수행하여 Fig. 4로 나타내었다.
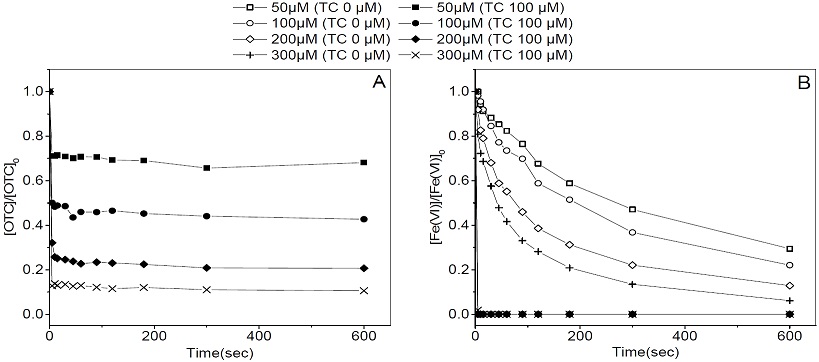
Effect of ferrate (VI) dosage on oxytetracycline removal (A) and ferrate (VI) decomposition (B) (pH : 7.0 ± 0.1, Water temp. : 20℃)
실험 결과, 투여된 페레이트의 양에 비례하여 옥시테트라사이클린의 제거율 또한 증가하는 것으로 확인되었다(Fig. 5). 페레이트를 50, 100, 200, 300μM을 투여할 경우의 옥시테트라사이클린의 제거율은 각각 29%, 52%, 74%, 86%이며, 10분 후의 옥시테트라사이클린 제거율은 각각 32%, 57%, 79%, 89%로, 초반 10초 전후로 빠른 반응이 발생하였으며, 이후 옥시테트라사이클린의 제거는 미미한 것으로 나타났다. 페레이트 잔류량을 측정한 결과, 투여 직후 빠르게 환원되어 검출되지 않았으며, 이는 옥시테트라사이클린이 분해 시 페레이트는 전량 소모된 것으로 보인다. 같은 수중 조건에서 옥시테트라사이클린이 없을 경우의 페레이트 잔류량을 보면, 50, 100, 200, 300μM의 페레이트를 투여할 경우, 10초 후 페레이트의 잔류량은 각각 94%, 95%, 82%, 72%이며, 10분 후 페레이트 잔류량은 각각 29%, 22%, 13%, 6%로 옥시테트라사이클린이 존재할 때보다 오래 잔류하며, 페레이트의 농도가 낮을수록 더 오래 잔류하는 것으로 나타났다.
이는 페레이트 투여량이 많을수록 페레이트끼리의 충돌빈도가 높아짐에 따라 페레이트 자체의 안정성이 떨어져서 옥시테트라사이클린을 분해하지 않고 자가분해되는 페레이트의 양이 많아짐을 뜻한다.
이를 고려하여 페레이트 투여량 대비 분해된 옥시테트라사이클린(OTC)의 양을 산정하면, 50μM 의 페레이트 투여 시 31.9μMOTC/50μMferrate(VI) =0.64, 100μM 투여 시 57.3μMOTC/100μMferrate(VI)=0.57, 200μM 투여 시 79.4μMOTC/200μMferrate(VI)=0.40, 300μM 투여 시 89.5μMOTC/300μMferrate(VI)=0.30으로서 페레이트 투여량이 많을수록 이에 따른 투입량 대비 옥시테트라사이클린의 분해효율은 떨어지는 것으로 나타났으나 오염물질의 처리 측면에서는 200μM 페레이트 투여량이 최적의 조건으로 판단된다.
그러므로 페레이트 투여량이 많을수록 대상물질을 더 많이 분해할 수 있으나, 페레이트를 많이 투여하게 되면 낭비되는 페레이트가 더욱 많아지므로, 페레이트 투여량 대비 대상물질의 분해 정도를 연구하여 적절한 페레이트 투여량을 결정하는 것이 중요할 것으로 판단된다.
3.2 중간생성물 연구
본 연구에서 HPLC-MS/MS를 이용하여 옥시테트라사이클린의 중간생성물을 검출하였으며, 기존의 AOPs 기술을 이용한 옥시테트라사이클린 분해경로와 페레이트의 반응 메커니즘을 연구하였다.
페레이트와의 반응에서 가장 흔히 나타나는 반응으로는 OH 라디칼에 의한 hydroxylation이 있다. 중간생성물 중 C22H24N2O10(m/z 477)가 hydroxylation 반응에 의해 생성된 것으로서, 해당 반응은 OH 라디칼에 의한 흔한 반응으로서, 이 중간생성물은 UV/H2O219), Fe2O3-TiO220)과의 반응에서도 발견되었다.
두 번째 반응은 탈락에 의한 것으로서, 옥시테트라사이클린의 네 번째 고리의 N-methyl기 중 하나가 탈락되면서 C21H22N2O9(m/z 447)이 생성되었다. C21H22N2O9은 다시 반응하여 나머지 N-methyl가 탈락되어 생성된 C20H20N2O9(m/z 433)과, 네 번째 고리의 -CONH2 중 -NH2가 탈락(deamination)되어 생성된 C21H21NO9(m/z 432), 그리고 dehydroxylation 반응으로 생성된 C20H18N2O8(m/z 415)과 C20H18N2O8 (mz/ 415)로 총 4가지의 중간생성물이 생성되었다.19)
마지막으로 네 번째 고리의 C=O가 탈락됨으로써 고리가 붕괴되는 decarbonation 반응으로 C21H24N2O8 (m/z 433)가 생성되었다. 그리고 OP 4의 두 번째 고리의 -OH가 탈락되는 dehydration 반응을 통해 C21H22N2O7(m/z 415)가 생성되고, 더 나아가 이 중간생성물에서 -OH에 의한 hydrogen abstraction과 quinonization으로 C21H20N2O8(m/z 429)가 생성되는 것으로 판단된다.19)
종합하면, 페레이트에 의해 OH 라디칼이 생성되고, 생성된 OH 라디칼이 옥시테트라사이클린과 반응하여 hydroxylation, demethylation, decarbonation 등의 반응이 일어나며, 최종적으로 CO2, H2O 등으로 무기물화21) 되는 것으로 판단된다.
4. 결 론
본 연구에서는 습식산화법으로 제조한 potassium ferrate(VI)를 이용하여 다양한 수중 환경 조건 하에서 옥시테트라사이클린을 분해함으로써 분해효율을 평가하였다. 옥시테트라사이클린은 염기성 환경에서 높은 분해효율을 보이며, 이는 pH가 높을수록 잔류율이 높아지는 페레이트의 특성에 기인한 것으로 판단된다. 또한 옥시테트라사이클린은 페레이트 투여량에 비례하여 분해율이 증가하나, 페레이트의 self-decay rate 또한 증가하여 결론적으로 페레이트 투여량 대비 분해효율은 떨어지는 것으로 나타났다. 추가적으로 중간생성물 연구를 통해 페레이트와 옥시테트라사이클린 사이의 반응 기작을 연구하였다. LC/MS/MS를 이용한 중간생성물 분석을 정리하면, 옥시테트라사이클린은 페레이트에 의해 hydroxylation, demethylation, decarbonation 등의 과정의 거쳐 최종적으로 CO2, H2O와 같이 무기물화 되는 것으로 생각된다.
Acknowledgments
본 연구는 “부경대학교 자율창의학술연구비 지원사업(CD20210818)”의 일환으로 수행되었음.
Author contributions
I. K. Kim; Supervision. K. D. Park; Investigation.
References
- Ministry of Agriculture, Food, and Rural Affairs, Animal and Plant Quarantine Agency, Ministry of Food and Drug Safety, 2020, "National monitoring of antibiotic usage and resistance in 2019: Livestock and food of animal origin", 11-1543061-000088-10, Ministry of Agriculture, Food, and Rural Affairs, 9.
-
I. Chantziaras, F. Boyen, B. Callens and J. Dewulf, 2014, "Correlation between veterinary antimicrobial use and antimicrobial resistance in food-producing animals: a report on seven countries", J. Antimicrob. Chemother., Vol. 69, No. 3, pp. 827-834.
[https://doi.org/10.1093/jac/dkt443]
-
R. I. Mackie, S. Koike, I. Krapac, J. Chee-Sanford, S. Maxwell and R. I. Aminov, 2006, "Tetracycline residues and tetracycline resistance genes in groundwater impacted by swine production facilities", Anim. Biotechnol., Vol. 17, pp. 157-176.
[https://doi.org/10.1080/10495390600956953]
-
D. W. Lee, L. J. Jun and J. B. Jeong, 2017, "Distribution of tetracycline resistance genes in pathogenic bacteria isolated from cultured olive flounder (paralichthys olivaceus) in jeju in 2016", J. Fish. Mar. Sci. Educ., Vol. 29, No. 3, pp. 834-846.
[https://doi.org/10.13000/JFMSE.2017.29.3.834]
-
L. Wollenberger, B. Halling-Sørensen and K. O. Kusk, 2000, "Acute and chronic toxicity of veterinary antibiotics to Daphnia magna", Chemosphere, Vol. 40, No. 7, pp. 723-730.
[https://doi.org/10.1016/S0045-6535(99)00443-9]
-
R. A. Figueroa-Diva, D. Vasudevan and A. A. MacKay, 2010, "Trends in soil sorption coefficients within common antimicrobial families", Chemosphere, Vol. 79, pp. 786-793.
[https://doi.org/10.1016/j.chemosphere.2010.03.017]
-
M. Pan and L. M. Chu, 2016, "Phytotoxicity of veterinary antibiotics to seed germination and root elongation of crops", Ecotox. Environ. Safe., Vol. 126, pp. 228-237.
[https://doi.org/10.1016/j.ecoenv.2015.12.027]
-
Y. Liu, X. He, X. Duan, Y. Fu and D. D. Dionysiou, 2015, "Photochemical degradation of oxytetracycline: Influence of pH and role of carbonate radical", Chem. Eng. J., Vol. 276, pp. 113-121.
[https://doi.org/10.1016/j.cej.2015.04.048]
-
Y. Y. Chen, Y. L. Ma, J. Yang, L. Q. Wang, J.M. Lu and C.J. Ren, 2017, "Aqueous tetracycline degradation by H2O2 alone: Removal and transformation pathway", Chem. Eng. J., Vol. 307, pp. 15-23.
[https://doi.org/10.1016/j.cej.2016.08.046]
-
Z. R. Hopkins and L. Blaney, 2014, "A novel approach to modeling the reaction kinetics of tetracycline antibiotics with aqueous ozone", Sci. Total Environ., Vol. 468-469, pp. 337-344.
[https://doi.org/10.1016/j.scitotenv.2013.08.032]
-
Y. Yang, Z. Zeng, C. Zhang, D. Huang, G. Zeng, R. Xiao, C. Lai, C. Zhou, H. Guo, W. Xue, M. Cheng, W. Wang and J. Wang, 2018, "Construction of iodine vacancy-rich BiOIAg @AgI Z-scheme heterojunction photocatalysts for visible-light-driven tetracycline degradation Transformation pathways and mechanism insight", Chem. Eng. J., Vol. 349, pp. 808-821.
[https://doi.org/10.1016/j.cej.2018.05.093]
-
G. H. Safari, S. Nasseri, A. H. Mahvi, K. Yaghmaeian, R. Nabizadeh and M. Alimohammadi, 2015, "Optimization of sonochemical degradation of tetracycline in aqueous solution using sono-activated persulfate process", Journal of Environmental Health Science and Engineering, Vol. 13, pp. 76-81.
[https://doi.org/10.1186/s40201-015-0234-7]
-
P. Drzewicz, A. Drobniewska, K. Sikorska and G. Nałęcz-Jawecki, 2018, "Analytical and ecotoxicological studies on degradation of fluoxetine and fluvoxamine by potassium ferrate", Environ. Technol., Vol. 40, No. 25, pp. 3265-3275.
[https://doi.org/10.1080/09593330.2018.1468488]
-
J. Deng, H. Wu, S. Wang, Y. Liu and H. Wang, 2019, "Removal of sulfapyridine by ferrate(VI): efficiency, influencing factors and oxidation pathway", Environ. Technol., Vol. 40, No. 12, pp. 1585-1591.
[https://doi.org/10.1080/09593330.2018.1426642]
-
M. Feng, J. C. Baum, N. Nesnas, Y. Lee, C. H. Huang and V. K. Sharma, 2019, "Oxidation of sulfonamide antibiotics of six-membered heterocyclic moiety by ferrate(VI): Kinetics and mechanistic insight into SO2 extrusion", Environ. Sci. Technol., Vol. 53, No. 5, pp. 2695-2704.
[https://doi.org/10.1021/acs.est.8b06535]
-
Y. Lee, J. Yoon and U. von Gunten, 2005, "Spectrophotometric determination of ferrate (Fe(VI)) in water by ABTS", Water Res., Vol. 39, pp. 1946-1953.
[https://doi.org/10.1016/j.watres.2005.03.005]
-
N. Graham, C. C. Jiang, X. Z. Li, J. Q. Jiang and J. Ma, 2004, "The influence of pH on the degradation of phenol and chlorophenols by potassium ferrate", Chemosphere, Vol. 56, pp. 949-956.
[https://doi.org/10.1016/j.chemosphere.2004.04.060]
-
C. Li, X. Z. Li and N. Graham, 2005, "A study of the preparation and reactivity of potassium ferrate", Chemosphere, Vol. 61, pp. 537-543.
[https://doi.org/10.1016/j.chemosphere.2005.02.027]
-
Y. Liu, X. He, X. Duan, Y. Fu, D. Fatta-Kassinos and D. D. Dionysiou, 2016, "Significant role of UV and carbonate radical on the degradation of oxytetracycline in UV-AOPs: Kinetics and mechanism", Water Res., Vol. 95, No. 15, pp. 195-204.
[https://doi.org/10.1016/j.watres.2016.03.011]
-
R. Li, Y. Jia, J. Wu, and Q. Zhen, 2015, "Photocatalytic degradation and pathway of oxytetracycline in aqueous solution by Fe2O3–TiO2 nanopowder", RSC Adv., Vol. 2015, No. 5, pp. 40764-40771.
[https://doi.org/10.1039/C5RA04540A]
-
K. D. Park and L. K. Kim, 2016, "Development of on-site process for refractory 2,4-dichlorophenol treatment", Journal of the Korean Society for Power System Engineering, Vol. 20, No. 1, pp. 42-49.
[https://doi.org/10.9726/kspse.2016.20.1.042]